2 Aprile 2021 ![]()
L’analisi sul nuovo vaccino da parte delle due ricercatrici dell’Istituto di Biologia e Patologia Molecolari del CNR, Roma.
Nonostante molti sforzi in corso sul fronte delle terapie (anticorpi monoclonali, inibitori delle proteasi e dell’RNA polimerasi virale, inibitori della fuoriuscita del virus dalle cellule), nessuno si è rivelato risolutivo per la COVID-19, almeno nella sua forma severa. I vaccini continuano dunque a rappresentare, attualmente, l’unica arma efficace per mitigare, se non fermare, la pandemia di COVID-19. In questo articolo vogliamo soffermarci sul nuovo vaccino prodotto dalla Johnson and Johnson, appena autorizzato in Europa.
Il vaccino della Janssen Pharmaceuticals Ad26.COV2.S
L’11 marzo l’EMA ha concesso l’autorizzazione ad uso di emergenza per il vaccino della Janssen Pharmaceuticals Companies di Johnson & Johnson, il cui nome tecnico è Ad26.COV2.S, seguendo l’autorizzazione concessa dalla l’FDA il 27 febbraio negli USA. Si tratterà del 4° vaccino contro la COVID-19 per i cittadini europei, dopo Pfizer/BioNTech, Moderna e Astra Zeneca. Indubbiamente, un aspetto unico estremamente vantaggioso di questo vaccino è la capacità di indurre una reazione immunitaria duratura dopo una sola iniezione.
Il vaccino è basato su un adenovirus a DNA, l’adenovirus 26 (Ad26), come veicolo (vettore) per portare al’interno delle nostre cellule il gene che codifica la proteina Spike del SARS-CoV-2. Si aggiunge alla famiglia dei vaccini basati su adenovirus umani, come il cinese della CanSino Biologicals (basato sull’Ad5) e il russo Sputnik (che utilizza una combinazione di Ad5 e Ad26) (ricordiamo che Astra Zeneca usa invece un adenovirus di scimpanzé, non infettivo per l’uomo). Gli adenovirus possono naturalmente infettare l’uomo, causando il raffreddore. Il loro impiego in terapia umana e nelle piattaforme vaccinali prevede protocolli di ingegnerizzazione molecolare che ne rendano impossibile la replicazione nelle cellule umane ospiti. Perciò, il vettore entra nelle cellule, “libera” il DNA da cui è prodotta la proteina Spike per un tempo sufficiente a scatenare una risposta immunitaria, dopodiché si “spegne”, come si dice in gergo tecnico. L’Ad26 è un sottotipo abbastanza raro di Adenovirus, che minimizza la possibilità che le persone ne siano state già infettate ed abbiano sviluppato anticorpi neutralizzanti.
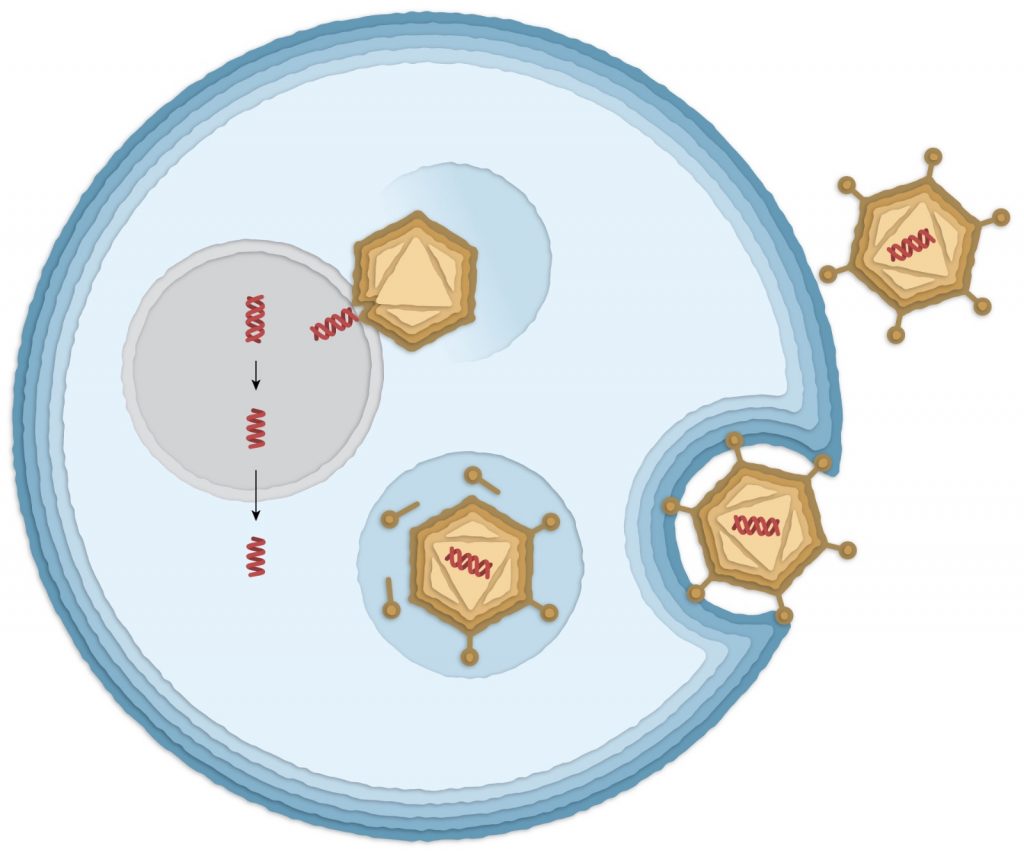
L’immagine mostra la struttura di Ad26, in cui è stato inserito il DNA per la proteina Spike (struttura a doppia elica in rosso). Ad26 entra in una cellula umana (la membrana cellulare è schematizzata in azzurro) e viene inglobato in vescicole intracellulari che lo trasportano al nucleo (in grigio). Qui il DNA viene rilasciato e trascritto in RNA (singola elica rossa) da cui verrà prodotta la proteina Spike. Da “How the Jonhson & Johnson vaccine works”, Corum e Zimmer, New York Times, 22/03/ 2021
Uno sviluppo di vaccini rapido ma rigoroso: quando non c’è nulla di nuovo sotto il sole
Com’è stato possibile un successo tanto rapido, ottenuto in meno di un anno, nello sviluppo di un vaccino efficace già dopo una singola somministrazione? L’ideatore del vaccino Johnson & Johnson, Dan Barouch (Professore di Medicina e Immunologia alla Facoltà di Medicina dell’Università di Harvard e direttore del Centro di Virologia e Ricerca sui Vaccini al Centro Medico Beth Israel Deaconess) lo ha recentemente spiegato in un seminario online per il CNR e l’Università di Pisa. Anche in questo caso, il rapido sviluppo poggi su due pilastri fondamentali:
- La presenza di precedenti ricerche consolidate nel corso di anni, che avevano già prodotto piattaforme efficaci per la sperimentazione di vettori, che dovevano essere solo “adattati” a produrre la proteina Spike di Sars-CoV-2;
- L’autorizzazione degli Stati a svolgere le fasi 1, 2 e 3 in sovrapposizione anzichè in sequenza. Come è noto, lo scopo dei trial di fase clinica 1/2 è testare, in piccoli gruppi (ordine delle centinaia di soggetti), la sicurezza e l’efficacia di un vaccino o farmaco, da verificare definitivamente nelle sperimentazioni di fase 3, su decine di migliaia di soggetti. Per far fronte alla pandemia, si è unanimemente convenuto di svolgere contemporaneamente le 3 fasi, in modo che ciascuna si sovrapponesse alla precedente quando questa avesse dato i primi risultati promettenti, imprimendo una notevole velocizzazione dei trial senza derogare al rigore delle verifiche.
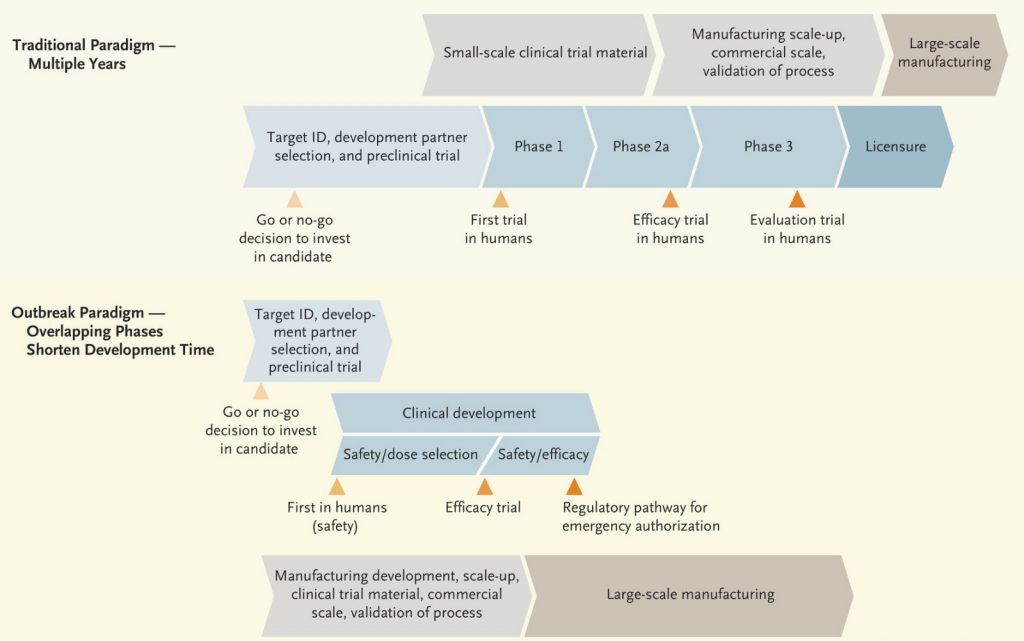
Confronto tra lo sviluppo temporale di un vaccino tradizionale (in alto) e lo sviluppo accelerato dei vaccini contro la COVID-19 (in basso). Da: Karim e de Oliveira, New England Journal of Medicine, 24 marzo 2021.
La piattaforma della Janssen Pharmaceuticals (AdVac® vaccine platform) basata su Ad26 era sviluppata dal 2003. Il vaccino Ad26.COV2.S nasce, quindi, da tecnologie consolidate da 17 anni per produrre vaccini contro Ebola, il virus respiratorio sinciziale e, soprattutto, Zika (mentre tentativi contro HIV-1 utilizzando lo stesso vettore non hanno avuto successo).
Al 2016 risale la prima evidenza che una sola somministrazione di un vaccino basato su Ad26 contro Zika fosse sufficiente all’immunizzazione nelle scimmie. Questo grande potenziale immunogenico dopo una sola somministrazione rappresenta un ovvio, quanto enorme, vantaggio logistico nella lotta contro una pandemia in cui debbono essere vaccinate miliardi di persone. Altri vantaggi sono la relativa semplicità della piattaforma, la facilità di produzione su larga scala e il fatto che non è richiesta una catena stringente del freddo per il trasposto e la conservazione.
Anche nel caso del vaccino Ad26.COV2.S, ha ricordato il Prof. Barouch, la storia è iniziata alla data cruciale del 10 gennaio 2020, quando i ricercatori dell’Istituto di Wuhan pubblicarono la sequenza del genoma a RNA del virus Cov-2. Era un venerdì. Barouch e collaboratori studiarono la sequenza durante il week-end (così come la coppia Tureci e Sahin per il vaccino BioNTech/Pfizer, Melissa Moore e collaboratori per Moderna, Sarah Gilbert e collaboratori per Oxford/Astra Zeneca, come abbiamo raccontato in un altro articolo). Su questa base, già il lunedì 13 gennaio fu possibile sintetizzare con tecniche molecolari i geni per la proteina Spike (ne furono inizialmente saggiate 7 versioni, portatrici di piccole differenze alla ricerca di quelle che meglio stabilizzassero la proteina) ed inserirli nell’adenovirus 26. Il 6 Febbraio furono immunizzati i primi topi e il 12 Febbraio i primi gruppi di macachi, rappresentanti dei primati non umani. I primi risultati sulla buona tollerabilità del vaccino e l’induzione di immunità in questi modelli animali sono stati pubblicati a maggio su Science; ulteriori dati sulla protezione conferita dopo una singola dose nei macachi sono stati pubblicati in luglio su Nature.
Il 22 luglio hanno preso ufficialmente avvio le fasi 1 e 2 sovrapposte. Il 21 settembre è iniziata la fase 3, che ha arruolato circa 45.000 persone, per testare l’efficacia di una dose singola, ed il 16 Novembre un secondo arruolamento di fase 3 di circa 30.000 persone per testare l’efficacia di un protocollo basato su 2 dosi.
Positivi risultati preclinici e clinici dopo una singola somministrazione
I dati preclinici pubblicati sulla rivista Vaccines a settembre 2020 hanno mostrato come, in modelli murini, il vaccino induca una risposta immunitaria umorale e cellulo-mediata molto robusta, l’ultima dipendente soprattutto da linfociti T-helper 1 (Th1), che producono interferone gamma e che, insieme ai linfociti Th2, aiutano i linfociti B, responsabili della memoria immune a lungo termine, a differenziare all’esterno dei centri germinativi e a produrre anticorpi maturi. I dati del trial di fase 2 (805 individui suddivisi in 3 gruppi per età, numero di dosi somministrati e numero di particelle virali inoculate), pubblicati su New England Journal of Medicine a gennaio scorso, riportano anche nell’uomo una buona tollerabilità del vaccino, con effetti collaterali sovrapponibili a quelli degli altri vaccini (dolore nel sito di iniezione, febbre, mal di testa, mialgia, stanchezza), più pronunciati nel gruppo 18-55 anni rispetto a quello degli over 65, che scompaiono dopo uno o due giorni.
In breve, ricordiamo i dati notevoli del vaccino Johnson & Johnson:
- Il gruppo dei vaccinati comincia a differenziarsi dagli individui trattati con placebo, per l’induzione di anticorpi, già a giorno 7 dopo una singola somministrazione; la copertura inizia dunque già dopo una settimana;
- Il 90% dei partecipanti sviluppa anticorpi neutralizzanti a 29 giorni dalla prima somministrazione, e il 100% dopo 57 giorni, con un titolo che resta costante almeno fino a 71 giorni (finestra d’osservazione considerata in questo studio);
- una seconda dose aumenta ulteriormente la quantità di anticorpi, che di per sé è comunque elevata;
- anche nell’uomo, come nei modelli animali, la risposta dei linfociti T si dimostra robusta, con l’insorgenza di linfociti T citotossici (CD8+ ma anche CD4+), soprattutto Th1, che producono interleuchina-2 e interferone gamma. Queste risposte sono leggermente meno forti tra gli over 65, ma ancora pronunciate;
I dati presentati all’FDA per la richiesta di autorizzazione negli USA, raccolti su un campione di 39.321 persone (19.630 riceventi il vaccino e 19.691 riceventi soluzione fisiologica come placebo), hanno mostrato un’efficacia del 67% nel prevenire la malattia medio/grave 14 giorni dopo la vaccinazione e del 66% 28 giorni dopo la vaccinazione. Ulteriori dati incoraggianti sono venuti dal completamento del trial di fase 3 (chiamato PHASE 3 – ENSEMBLE) che ha arruolato 43.783 partecipanti (21.895 trattati col vaccino e 21.888 con placebo) in 8 Paesi distribuiti in 3 continenti (Sud Africa, alcuni Paesi del Sud America, Messico, USA) per verificare l’efficacia di una singola somministrazione, che, come abbiamo detto, era attesa sulla base delle precedenti campagne contro Zika. Interessante notare che il 34% dei partecipanti aveva 60 anni o più, ed il 41% presentavano co-morbidità che rappresentano fattori di rischio per una progressione severa della Covid-19. I soggetti sono stati seguiti per 8 settimane. È stata rilevata un’efficacia, contro le forme severe della Covid-19, del 77% dopo 14 giorni dalla somministrazione e dell’85% dopo 28 giorni. Inoltre, il vaccino si è dimostrato efficace nel prevenire l’ospedalizzazione nel 100% dei casi.
Di rilievo, inoltre, è che il vaccino Johnson & Johnson è efficace anche contro la variante B.1.351 (Sud-Africana), che invece non è riconosciuta dagli anticorpi indotti dagli altri vaccini in commercio (ad eccezione di Moderna, per quanto pubblicato fino ad ora).
Quanto durano gli anticorpi indotti dal vaccino Johnson & Johnson? Sappiamo che essi sono ancora presenti nel gruppo degli arruolati in fase 3 di settembre, dunque almeno 6 mesi. Nei macachi, essi sono ancora presenti dopo un anno. Verifiche a più lungo termine, oltre la finestra ora a disposizione, ne indicheranno la persistenza reale nell’uomo.
Vogliamo chiudere con un’osservazione del Prof. Baruch. Ricorda Baruch che il 10 gennaio 2020, quando i ricercatori di Wuhan resero nota la sequenza del virus, si erano registrati 41 casi di infezione, di cui 1 con esito letale. Qualche giorno fa, il 28 marzo 2021, il centro di osservazione mondiale della John Hopkins University ha contato quasi 127 milioni di casi nel mondo, con 2 milioni e 700 mila morti. L’evoluzione e diffusione del contagio hanno enormemente complicato l’analisi epidemiologica e causato non pochi errori nella gestione della malattia. Alla luce di tutto questo, e della dimostrata capacità del virus di mutare, abbiamo davvero bisogno di un ampio ventaglio di vaccini basati su strategie complementari. È fondamentale tenere a mente che tutti i vaccini hanno efficacia altissima nel prevenire il decorso fatale della malattia ed anche l’ospedalizzazione. Nulla è stato improvvisato e nulla sarebbe stato possibile senza lo sviluppo di piattaforme già ideate e sperimentate in anni di studio e di ricerca.







