26 Aprile 2021 ![]()
Diciamolo subito: che vaccini prodotti, testati e approvati in breve tempo avrebbero causato cambi di passo, brusche fermate e modifiche nell’applicazione dei protocolli era atteso. Le lacune comunicative sul perché – scientifico, politico o logistico – di certe decisioni sono, invece, meno comprensibili. Facciamo chiarezza con l’approfondimento di Barbara Illi, Istituto di Biologia e Patologia Molecolari, CNR, Roma
Sono ancora molti gli aloni di incertezza che circondano le campagne di vaccinazione nei vari Paesi europei, che sembrano muoversi secondo criteri nazionali, piuttosto che in adesione alle decisioni dell’EMA. Partiamo proprio dalla recente decisione di quest’ultima di “sbloccare” il vaccino Janssen (Johnson&Johnson) per cercare di chiarire quella che sembra una debolezza dell’agenzia regolatoria per i farmaci europea.
L’EMA e Ponzio Pilato
L’EMA, sia in occasione del “via libera” al vaccino Vaxzevria (Astra Zeneca) che al vaccino della Janssen Pharmaceuticals, dopo la valutazione di rarissimi casi di trombosi associati a diminuzione di piastrine, è stata accusata di non prendere decisioni nette e di demandare ai singoli Stati quali limitazioni imporre ai criteri per la somministrazione dei vaccini. Un “Ponzio Pilato” che lascia il destino delle campagne di vaccinazione ai singoli membri dell’UE. In realtà, l’EMA è stata molto chiara nelle sue indicazioni: secondo il PRAC (Pharmacoviglilance Risk Assessment Committee) sia il Vaxzevria che il vaccino di Jhonson&Johnson possono essere utilizzati senza limitazioni (sesso, età) in virtù dell’estrema rarità degli eventi tromboembolici – in ragione di 1/600000-1/1000000) – per i quali non è stata ancora dimostrata alcuna particolare predisposizione e perché i benefici della vaccinazione superano enormemente i rischi di un raro evento avverso. La correlazione tra il verificarsi di questi eventi e la somministrazione dei vaccini entro le 2 settimane precedenti il verificarsi dell’evento avverso è stata dichiarata “possibile”, non certa. Lo studio di questi fenomeni è, attualmente, investigato a fondo ed una prima pubblicazione del gruppo dell’ematologo tedesco Andreas Greinacher sul New England Journal of Medicine dimostrerebbe di aver trovato una prima spiegazione alla base di questi rari eventi. Si tratterebbe di una reazione autoimmune contro le piastrine che occorre in alcuni individui dopo la vaccinazione con Vaxveria, come abbiamo detto in un precedente articolo. Il meccanismo è ancora sconosciuto e non è dimostrato dipenda dal “veicolo” (ossia l’adenovirus di scimpanzé) che trasporta Spike o da Spike stessa. Verosimilmente, lo stesso meccanismo sottende gli eventi tromboembolici dopo la somministrazione del vaccino Janssen.
Tuttavia, dopo aver concluso che sia Vaxzevria che il vaccino Janssen sono sicuri ed efficaci, l’EMA ha lasciato ai singoli Stati Europei la decisione se imporre o meno limitazioni. Perché? La risposta è nelle 4 diverse procedure che lo statuto dell’EMA prevede per l’autorizzazione all’immissione in commercio dei farmaci, contrariamente all’ FDA americana, che nel momento in cui scriviamo ha “liberato” il vaccino Janssen.
Queste sono:
- La procedura centralizzata: questa coinvolge tutti gli Stati Europei ed è obbligatoria per alcuni specifici farmaci, come gli anti-tumorali, i farmaci per il diabete, le malattie neurodegenerative, malattie autoimmuni e malattie virali. L’accesso alla procedura è facoltativo per altri tipi di farmaci giudicati innovativi da un punto di vista tecnologico, scientifico e terapeutico e qualora si ritenga che l’autorizzazione comunitaria sia utile per i pazienti
- La procedura di mutuo riconoscimento: questa procedura si attua quando uno Stato, che ha già approvato un farmaco, chiede l’autorizzazione per l’immissione in commercio agli altri Paesi. Di solito, investe il commercio di farmaci tradizionali
- La procedura decentralizzata: si applica quando un farmaco non ancora autorizzato in Europa viene autorizzato in diversi Stati membri (un esempio potrebbe essere l’autorizzazione del vaccino russo Sputnik nello Stato di San Marino)
- Procedura nazionale: è applicata a tutti i prodotti che devono essere immessi in commercio in uno specifico Stato e segue, di solito, la procedura centralizzata
È chiaro, quindi, che gli stati Europei hanno ampia autonomia nel decidere se immettere un farmaco in commercio e con quali limitazioni.
Il problema dell’età: quale vaccino, a chi e perché
I rari eventi tromboembolici sono occorsi in individui al di sotto dei 49 anni. In Italia, come in Germania si è quindi deciso di somministrare il vaccino solo a persone con età superiore ai 60 anni, in Francia a 55 anni e nel Regno Unito a 30. La ragione alla base della scelta italiana è che il rischio di mortalità per Covid al di sotto dei 60 anni è di 6/1000 contro il 3% della decade successiva. Si è quindi deciso di non far correre alle persone al di sotto dei 60 anni un rischio, seppur rarissimo, di sviluppare una patologia pericolosa, a fronte di un rischio altrettanto basso (ma sempre superiore al rischio del verificarsi del suddetto evento avverso) di morire per Covid. Ricordiamo che un vaccino si somministra a persone sane.
I Paesi europei che ancora utilizzano Vaxzevria (la Danimarca lo ha definitivamente sospeso) hanno seguito questa linea.
Il Regno Unito, al contrario, ha deciso di sospenderlo per persone al di sotto dei 30 anni e la ragione è che i benefici della vaccinazione, a partire dai 30 anni in poi, superano – e non di poco – i rischi di eventi avversi, come riportato nella figura sottostante.
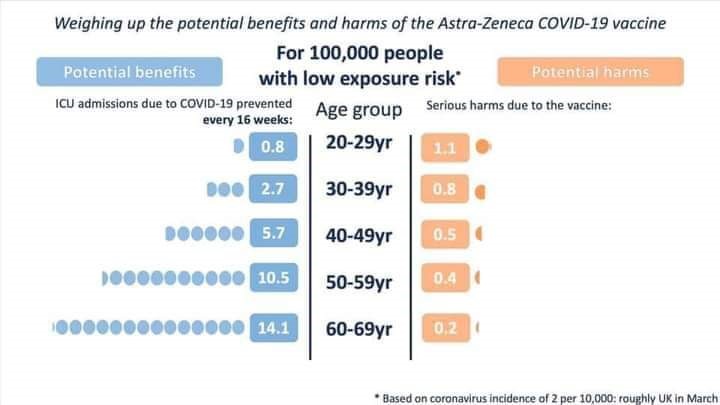
Tratto dal sito https://wintoncentre.maths.cam.ac.uk
Non tutti sanno che
Era ovvio che dopo i casi di tromboembolia associati alla somministrazione di Vaxzevria, il vaccino Janssen, basato anch’esso su un adenovirus, fosse particolarmente attenzionato. I vaccini adenovirali sono diventati sorvegliati speciali. Ma i vaccini a RNA Pfizer e Moderna causano o no trombosi? La risposta è sì, almeno negli Stati Uniti (non sembrerebbe così in Europa). Infatti, l’equipe di James Bussel, professore emerito al Weill Cornell Medical College di New York, ha riscontrato 17 casi di trombosi associati a diminuzione di piastrine – la porpora autoimmune trombocitopenica (Immune Thrombocytopenic Purpura, ITP) – su 20 milioni di riceventi (circa 1/1000000) la prima dose del vaccino Pfizer o Moderna. Lo stesso Bussel ha riportato alla Società Americana di Ematologia che non c’è da sorprendersi della rilevazione di questi casi, asserendo l’incidenza di questi comparabile a quella che si sarebbe evidenziata se fossero stati semplicemente una coincidenza dopo la vaccinazione, forse amplificata dalla rafforzata sorveglianza dei pazienti sintomatici. Lo stesso Bussel ha dichiarato che un legame con i vaccini Pfizer e Moderna è possibile, sebbene molto raro. Complessivamente, il sistema che registra gli eventi avversi correlati ai vaccini statunitense (il Vaccine Adverse Event Reporting System, VAERS) alla fine di gennaio aveva segnalato 36 casi di trombosi associati a trombocitopenia su 31 milioni di vaccinati sia con Pfizer che Moderna.
Quindi, i casi Europei e quelli Americani sono in qualche modo legati? A questa domanda non c’è ancora risposta, ma solo alcune ipotesi. Una di queste è che sia i vaccini a RNA che quelli adenovirali possano indurre la sintesi di Spike all’interno di megacariociti e piastrine scatenando una risposta autoimmune contro di esse, come ha riportato Hamid Merchant, dell’Università di Huddersfield (UK), in una lettera al British Medical Journal dell’11 marzo scorso.
Ciò che ci preme sottolineare è che eventi simili si sono verificati con tutti i vaccini attualmente in commercio contro la COVID-19. A chi scrive è noto che l’EMA sta verificando l’incidenza di simili eventi trombotici anche in Europa, per gli altri vaccini. Certamente, sorprende la decisione di Pfizer e Moderna di rifiutarsi di aderire alle ricerche su questi rari eventi avversi su richiesta di Jhonson&Jhonson, come riportato dal Wall Street Journal.
Il “mix&match”
Un problema che si pone adesso, per chi è stato vaccinato con la prima dose di Vaxzevria, è se sia sicuro ricevere la seconda dose o se non sia meglio passare ad un altro vaccino per il richiamo.
Sulla sicurezza di questa operazione, la comunità scientifica è divisa. Alcuni immunologi ritengono non dovrebbero esserci controindicazioni perché tutti i vaccini veicolano all’interno delle cellule la stessa proteina Spike. Tuttavia, questo non è del tutto vero. I vaccini Pfizer e Moderna hanno al loro interno una Spike modificata in modo che il suo RNA messaggero sia più stabile e la proteina possa assumere una determinata conformazione all’interno delle nostre cellule e sia più immunogenica. Allo stesso modo, nel vaccino Janssen, Spike ha subito alcune modifiche che la rendono più stabile. Nel vaccino Vaxzevria, c’è una Spike fusa all’attivatore del plasminogeno, per aumentarne l’immunogenicità. Quanto queste modificazioni possano influire sul pannello di anticorpi indotti nell’individuo che riceve i diversi vaccini e sulle popolazioni di linfociti T devoluti alla risposta immunitaria cellulo-mediata non è noto. Inoltre, una risposta immunitaria viene scatenata contro tutte le componenti del vaccino. Questo è particolarmente vero per i vaccini adenovirali, che inducono una risposta immunitaria anche contro l’adenovirus stesso (e questa è la ragione principale della loro minore efficacia), non tanto per i vaccini a RNA, il cui involucro di grasso è inerte. In buona sostanza, chi ha ricevuto una prima dose di un determinato vaccino ha un sistema immunitario che è “programmato” a rispondere a quel vaccino, con determinati plotoni e munizioni.
In realtà, l’ipotesi del mix di vaccini era già stata fatta alla luce della possibilità di una difficoltà di reperimento dei diversi vaccini, tanto che la Gran Bretagna ha fatto partire un trial clinico per verificare la sicurezza e l’efficacia di questa ipotesi. Inizialmente, il trial prevedeva la mescolanza tra i vaccini Vaxzevria e Comirnaty (il nome commerciale del vaccino Pfizer) in varie combinazioni tra loro e col placebo (“mix&match”), ma a metà aprile l’Università di Oxford ha annunciato che verrà esteso anche ai vaccini Moderna e Novovax. Il trial – che si chiama ComCOV – arruolerà complessivamente 1050 persone a partire dai 50 anni di età che abbiano ricevuto la prima dose di un vaccino anti-COVID-19 nelle 12 settimane precedenti ed è stato preceduto da esperimenti in topi in cui si è dimostrata un’efficacia maggiore della mescolanza del vaccino Vaxzevria e Comirnaty nello stimolare l’immunità. I risultati sono attesi per giugno e lo scopo primario è dimostrare che il mix di vaccini non infici la risposta immunitaria e non dia effetti indesiderati maggiori della somministrazione del singolo vaccino in prima e seconda dose.
Il buono, il brutto, l’incerto
Mescolare 2 vaccini basati su piattaforme diverse, secondo alcuni immunologi, potrebbe avere il vantaggio di potenziare la risposta immunitaria specifica contro Spike. I vaccini Vaxzevria e Comirnaty, ad esempio, inducono anticorpi contro porzioni diverse di Spike e questo potrebbe aumentare la varietà di anticorpi che riconoscono il maggiore antigene di SARS-CoV-2. Inoltre, alla seconda dose, non si produrrebbero anticorpi contro il veicolo di Spike, rendendo più efficace la risposta immunitaria. Tuttavia, il vero problema di mescolare vaccini basati su piattaforme diverse è l’assenza, al momento, di qualunque indicazione su potenziali effetti non desiderati. La verità, come riportato del Centro per il Controllo e la Prevenzione delle Malattie statunitense (Centre for Disease Control and Prevention, CDC) e dall’EMA, la sicurezza e l’efficacia di questa procedura non è stata ancora dimostrata. Il CDC sconsiglia fortemente il mix di vaccini, che potrebbe essere applicato a situazioni eccezionali, come la difficoltà di reperimento delle seconde dosi di uno specifico vaccino. È chiaro che, sotto questo aspetto puramente logistico, il mix di vaccini sarebbe senz’altro un vantaggio. Inoltre, accelererebbe molto le campagne vaccinali laddove si disponesse di 2 o 3 vaccini in quantità differenti. Tuttavia, alla luce delle dichiarazioni degli scienziati che, seppur favorevoli, asseriscono che bisogna aspettare i dati sperimentali, e delle raccomandazioni dei maggiori enti regolatori che vigilano sul controllo e la prevenzione delle malattie e sui farmaci, le decisioni di Francia e Germania di somministrare un vaccino a RNA a chi ha ricevuto la prima dose di Vaxzevria, sembra più dettata da aspetti “psicologici” che non scientifici. In Italia, l’AIFA ha raccomandato di somministrare Vaxzevria in seconda dose a chi ha già ricevuto la prima, come la Gran Bretagna.
In assenza di dati sperimentali, chi scrive ritiene che seguire percorsi consolidati sia la scelta migliore da un punto di vista scientifico. Tali percorsi prevedono l’ottenimento di dati sperimentali, prima, e l’approvazione dei protocolli di trattamento, poi, dalle agenzie che vigilano sui farmaci. Deviare da tali percorsi potrebbe significare addentrarsi in tentativi dall’esito incerto ma, soprattutto, renderebbe vana l’esistenza di quegli stessi organismi di controllo in cui l’intero pianeta ripone ancora la sua fiducia.